ELIMINATION OF MANDIBULAR DEFECTS IN PATIENTS WITH MALIGNANT NEOPLASMS USING DESIGNS FROM POROUS NICKEL TITANIUM
Radkevich A.A. – MD, Professor of Dentistry Department at IPO KrasGMU (Krasnoyarsk)
Gantimurov A.A. – Candidate of Medical Sciences, Head of Municipal Dental Clinic №8 (Krasnoyarsk)
Gunther V.E. – Honoured Worker of Science, Doctor of Technical Sciences, Director of the Medical Research Institute of Materials and Shape Memory Implants at SFTI (Tomsk)
Summary. The article presents the clinical observation of 16 patients with malignant neoplasms of the lower jaw. All the patients underwent resection of the mandible with the substitution for the flaws with endoprostheses of porous NiTi. In 10 cases a course of preoperative radiotherapy at a dose of 42-44 gr. was conducted. The results of surgical treatment showed high efficiency of the technology.
Keywords: endoprosthetics of mandibular defects, nickel titanium (NiTi)
В хирургии опухолевых поражений нижнечелюстной кости, в связи с топографо-анатомическими особенностями области рта, нижней зоны лица и шеи, возникают сложности, связанные с удалением обширных злокачественных новообразований в пределах здоровых тканей, вследствие перевода пациента из категории онкологического больного в группу больных с дефектами и деформациями лица, функциональными нарушениями со стороны жевательного аппарата, височно-нижнечелюстного/ых сустава/ов и др. Из сказанного следует, что зачастую радикальное иссечение патологических тканей не приводит к полному выздоровлению пациента.
У лиц имеющих злокачественные опухоли на эффективность реабилитационных мероприятий негативно влияет в ряде случаев необходимость применения комбинированного или комплексного метода лечения – сочетания оперативного воздействия с лучевой и химиотерапией. Последние оказывают отрицательное воздействие на репаративные процессы, что в значительной мере повышает риск успешности реконструктивных операций, в силу чего большинство специалистов после удаления злокачественных опухолей первичную костную пластику не проводят.
При выборе оперативного метода лечения опухоли и дисплазии костной ткани необходимо учитывать характер и вид патологического процесса, особенности его течения (скорость роста, склонность к рецидивированию), локализацию, распространенность, возраст, соматическое состояние больного, а также одномоментную или последующую возможность восстановления анатомической формы и функциональных особенностей поврежденной кости и мягких тканей лица.
Реабилитация больных с новообразованиями нижней челюсти должна решать следующие задачи:
1. Воздействие на пораженные структуры (оперативное, лучевое, химиотерапевтическое, в зависимости от характера поражения);
2. Устранение костного и/или мягкотканного дефекта;
3. Восстановление функциональных особенностей височно-нижнечелюстного/ых сустава/ов и жевательного аппарата путем костной пластики, эндопротезирования или зубочелюстного протезирования.
В целях восстановления анатомических и функциональных нарушений у больных данной категории применяют костную пластику с использованием различного рода свободных трансплантационных материалов [1, 7], замещение изъянов нижнечелюстной кости и височно-нижнечелюстного сочленения эндопротезами, изготовленными из нержавеющей стали, титана, хромокобальтового сплава, полимеров, керамики, драгоценных камней (сапфиры) и других, не проявляющих в условиях нагрузки и разгрузки эффекта запаздывания [2-4, 8, 14, 15]. Однако результаты таких операций не могут удовлетворять требованиям больных и клиницистов ввиду резорбции и отторжения трансплантационных и имплантационных материалов, что обусловлено нежизнеспособностью аллогенных и ксеногенных тканей, гибелью остеоцитов в толще аутотрансплантатов, отсутствием биомеханической совместимости применяемых имплантатов с тканями организма. Применение васкуляризированных трансплантатов в сочетании с микрохирургической техникой [5, 9, 13] травматично, кроме того, используемые костные трансплантаты по форме не соответствуют замещаемому изъяну, а искусственно создаваемый в них кровоток зачастую становится неудовлетворительным ввиду тромбоза микрососудов в ближайшем послеоперационном периоде, что, несомненно, отрицательно сказывается на конечном результате. Комбинации перечисленных технологий [6, 10-12] не лишены вышеуказанных недостатков.
Значительный вклад в развитие имплантологии внесли исследования, связанные с разработкой технологии получения пористых материалов на основе никелида титана, выполненные в Сибирском физико-техническом институте. Особенно важным является создание сплава ТН–10П (пористый). Технология получения и обработки сплава такова, что позволяет добиваться в заданном диапазоне определенной величины пор и создания открытой по¬ристой структуры. Имплантаты из данного материала обладают высокой биологической инертно¬стью, нетоксичны и отвечают всем требованиям, предъявляемым к имплантатам. Биосовместимость таких материалов дает возможность им оставаться стабильными в организме, при этом обес¬печивать надежную фиксацию к окружающим тканям путем образования и роста тканевых структур в порах имплантата.
Целью работы явилось повышение эффективности хирургического лечения больных со злокачественными новообразованиями нижней челюсти на основе разработки новых медицинских технологий с использованием эндопротезов из пористого никелида титана.
В НИИ медицинских материалов и имплантатов с памятью формы (г. Томск) для одномоментного замещения тела, угла и ветви нижней челюсти, включая головку, разработан эндопротез, представляющий собой конструкцию, по конфигурации соответствующую анатомической форме мыщелкового отростка и ветви нижней челюсти, к которой фиксированы компоненты, заменяющие угол и тело челюсти, имеющие правый и левый варианты, данная конструкция может быть изготовлена и без головки, а так же в полном варианте, в зависимости от задачи операции. В целях предотвращения прорезывания эндопротеза сквозь слизистую оболочку полости рта или мягкие ткани лица, тело последнего покрывают волокнистым или плетеным тонкопрофильным никелидом титана путем послойной обмотки в 2 – 3 и более слоев (рис. 1). Размеры и конфигурацию эндопротеза определяют индивидуально на основании рентгенологических исследований (спиральной компьютерной томографии – послойных и объемных изображений).
Методика непосредственного эндопротезирования в целях замещения головки, ветви и тела нижней челюсти. Оперативный доступ к очагу поражения осуществляют из зачелюстной, поднижнечелюстной и подподбородочной областей или со стороны полости рта (в зависимости от клинической ситуации). Удаляют пораженные структуры нижней челюсти или образуют ложе для эндопротеза с формированием суставной впадины и изоляции костной раневой поверхности тканевым никелид-титановым имплантатом или без таковой. Эндопротез устанавливают в подготовленное ложе головкой в сторону суставной впадины, другую часть фиксируют к декортицированной поверхности фрагмента нижней челюсти с наружной стороны при помощи фиксирующих устройств из никелида титана. Жевательные мышцы фиксируют к эндопротезу аналогично предыдущему способу, далее проводят фиксацию мышц опускающих нижнюю челюсть (подбородочно-язычных, подбородочно-подъязычых, челюстно-подъязычной, передних брюшек двубрюшных мышц, если таковые пересекали) к телу эндопротеза. Рану послойно ушивают, дренируют в течение 2–3 суток.
Методика отсроченного эндопротезирования в целях замещения головки, ветви и тела нижней челюсти. Эффективность реабилитации у больных с отсутствием головки, ветви и дефектом тела нижней челюсти связана с восстановлением жевательной функции. Для достижения указанной цели необходимо оптимальное пространственное расположение эндопротеза относительно верхнечелюстных костей и оставшейся части нижней челюсти. Только в этом случае возможно получение удовлетворительного функционально результата. С этой целью разработана технология последовательности проведения реабилитационных мероприятий у данной категории пациентов, заключающейся в удалении патологических тканей (резекции нижней челюсти и др.) в случаях, если данное вмешательство не было выполнено ранее, определении центрального соотношения челюстей, изготовлении временной ортопедической конструкции, фиксирующей нормальное положение оставшейся части нижней челюсти, выполнении реконструктивной операции и последующего замещающего зубочелюстного протезирования.
Особенностью резекции нижней челюсти у данной категории больных является то, что после отсечения мышц от макропрепарата, оставшиеся части погружают внутрь вязаной тонкопрофильной тканевой структуры на основе никелида титана типа «чулка», и в таком состоянии оставляют в операционной ране. Указанное мероприятие на этапе эндопротезирования позволяет выделять эти мышцы из рубцово-измененных тканей и осуществлять последующую фиксацию к телу эндопротеза для восстановления функции.
Изготовленный нижний зубочелюстной протез фиксируют в полости рта больного, после чего проводят оперативное вмешательство, заключающееся в иссечении рубцово-измененных тканей в зоне ранее проведенной операции, рассечении мягких тканей до слизистого или подслизистого слоя с образованием ложа для эндопротеза, скелетировании и образовании декортицированной поверхности с наружного края фрагмента нижней челюсти, фиксации эндопротеза и мышц согласно предыдущей технологии, укрывании последнего мягкими тканями, ушивании раны. У лиц с сохраненными головками нижней челюсти эндопротез фиксируют с наружной стороны фрагментов челюсти к декортицированным поверхностям.
При необходимости для улучшения соотношения тканей протезного ложа к протезу в зоне реконструированного изъяна последующее зубочелюстное протезирование осуществляют индивидуально, в сроки 1-3 месяца от операции.
Согласно разработанной технологии проведено лечение 16 больных в возрасте от 53 до 74 лет со злокачественными новообразованиями нижней челюсти II и III, а и б стадии. Пациентам выполнены резекции нижней челюсти, в зависимости от показаний, тканей дна полости рта, щечной и подбородочной областей. При наличии метастазов в лимфатические узлы шеи было проведено футлярно-фасциальное их иссечение. В 10 случаях оперативному вмешательству предшествовала лучевая терапия в дозе 42-44 гр. Изъяны нижнечелюстной кости замещали эндопротезами из пористого никелида титана. У 10 больных применили отсроченное, у 6 непосредственное эндопротезирование. Причинами отсроченного эндопротезирования являлись обращения по поводу наличия послеоперационных дефектов тела и/или ветви нижней челюсти после удаления опухолей в других клиниках без их замещения, неудовлетворительные результаты костной пластики или эндопротезирования с применением других конструкций эндопротезов, первичные оперативные вмешательства по поводу нагноения опухолей и/или значительного некроза тканей. Характеристика замещенных изъянов отражена в табл. 1.
Характеристика замещенных изъянов у лиц с патологическими состояниями нижней челюсти (n=16)
| Характер изъяна | Количество больных |
| Ветвь, угол и тело челюсти до подбородочного отдела, исключая головку | 2 |
| Ветвь, угол и тело челюсти до подбородочного отдела, включая головку | 2 |
| Угол и тело челюсти до подбородочного отдела | 2 |
| Тело челюсти в области премолярно-молярного сегмента | 1 |
| Подбородочный отдел тела челюсти | 1 |
| Половинное замещение челюсти | 3 |
| Ветвь, угол и тело челюсти, включая головку и подбородочный отдел противоположной стороны | 2 |
| Ветвь, угол и тело челюсти, включая головку до премолярно-молярного сегмента противоположной стороны | 2 |
| Полное замещение челюсти | 1 |
Послеоперационное ведение больных по общепринятой методике, направленной на раннюю функциональную нагрузку. У всех больных послеоперационный период протекал благоприятно, значимых осложнений не наблюдали. Ближайший послеоперационный период сопровождался незначительной воспалительной реакцией в зоне вмешательства, которая ликвидировалась к 7-8 суткам. У 5 человек наблюдали частичный постлучевой некроз тканей поднижнечелюстной и подподбородочной областей в проекции эндопротеза на 2-3 неделе от вмешательства, что потребовало удаление нежизнеспособных тканей и устранения тканевых изъянов кожно-фасциальномышечными лоскутами, заимствованными из бокового и переднего отделов шеи.
Отдаленные результаты лечения (от 1 года до 12 лет) показали отсутствие процидивов заболевания, нормализацию объема открывания рта и функциональных особенностей зубочелюстного аппарата. Таких явлений, как прорезывание эндопротеза сквозь мягкие ткани в ротовую полость или наружу, перелом и миграция установленной конструкции не выявлено.
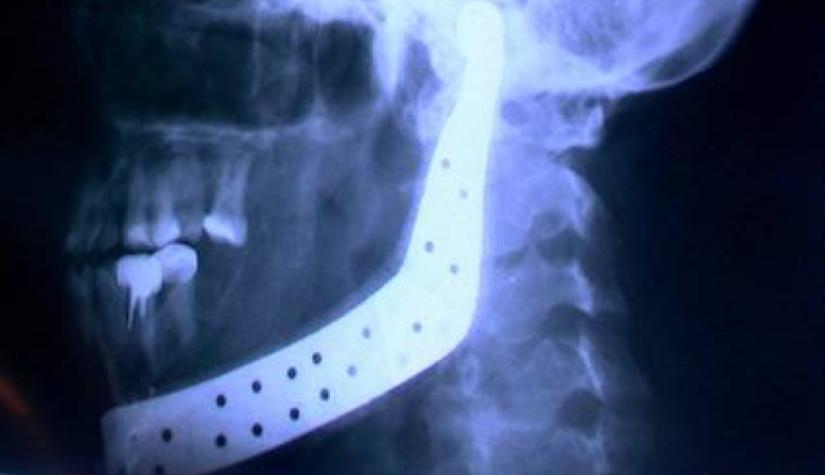
На рис. 2 представлены рентгенологические картины больной 53 лет с раком тела нижней челюсти справа IIIб стадии до и через 24 мес после оперативного лечения.
Таким образом, положительный опыт применения эндопротезов из пористого никелида титана для замещения дефектов различных отделов нижней челюсти, в том числе мыщелковый отросток, изготовленных в соответствии с анатомическими особенностями пораженного органа, позволяет сделать вывод о возможности полноценного восстановления утраченных анатомо-функциональные особенностей зубочелюстного аппарата у данной категории больных, включая состояния после лучевой терапии. Благодаря соответствию гистерезисного поведения утраченного органа и реципиентных тканей с гистерезисным поведением всей комплексной системы эндопротеза, соединительные ткани со стороны окружающих имплантат областей прорастают сквозь пористую структуру имплантата, не вызывая агрессивных реакций со стороны организма. Остеосинтез устройствами из никелида титана обеспечивает стабильную фиксацию эндопротеза к фрагменту нижней челюсти, дает возможность осуществления ранней жевательной нагрузки. Покрытие тела эндопротеза волокнистым или плетеным тонкопрофильным никелидом титана путем послойной обмотки создает сверхэластичную упругую систему, препятствует прорезыванию эндопротеза сквозь окружающие мягкие ткани. Сверхэластичные тонкопрофильные сетчатые имплантаты, фиксированные на культи жевательных и мышц, опускающих нижнюю челюсть, способствуют прочности фиксации последних к волокнистому слою эндопротеза, предотвращая разволокнение, не препятствуют сократительной способности мышц и возвращению их в исходное положение в процессе функционирования жевательного аппарата.
Рис. 1. Эндопротезы из пористого никелида титана
Рис. 2. Рентгенологическая картина больной с раковым поражением нижней челюсти до и после оперативного лечения
Литература:
1. Возможности комбинированной костной пластики при замещении апериостальных дефектов нижней челюсти / Н.Н. Бажанов, Г.П. Тер-Асатуров, Ю.Н. Сергеев и др. // Мат. IX ежегодного науч. форума «Стоматология 2007», посвящ. 45-летию ЦНИИС. – М., 2007. – С. 215–218.
2. Возможности хирургического лечения местнораспространенного и рецидивного рака ротоглотки // Д.В. Сикорский, С.О. Подвязников, А.А. Чернявский и др. // Современная онкология.– 2012.– №3.– С. 50-53.
3. Кропотов М.А. Хирургические вмешательства на нижней челюсти при раке слизистой оболочки полости рта / М.А. Кропотов // Сибирский онколог. журн.– 2010.– №3.– С. 66-68.
4. Митрошенков Н.П. Пластика дефектов нижней челюсти с использованием реконструктивных имплантатов системы «UniLock» / Н.П. Митрошенков // Новое в стоматологии.– 2007.– №5.– С.33-42.
5. Результаты костной пластики нижней челюсти васкуляризированными аутотрансплантатами / Н. В. Калакуцкий, С. Я. Чеботарев, О. Ю. Петропавловская и др. // Стоматология.– 2006.– №6.– С. 36-39.
6. Реконструкция нижней челюсти с применением сложносоставных комплексов тканей // С.П. Галич, А.В. Резников, С.И. Лысенко и др. // Реконструктивна хiрургiя.– 2011.– №1.– С. 52-54.
7. Чудаков О.П. Первичная костная пластика нижней челюсти аллогенным ортотопическим трансплантатом с инкорпорированными в него эндостальными дентальными имплантатами / О.П. Чудаков, В.А. Шаранда // Современная стоматология.– 2007.– №4.– С. 37-39.
8. Adell R. Dental rehabilitation in 101 primarily reconstructed jaws after segmental resections – Possibilities and problems. An 18-year study // R. Adell, B. Svensson, T.Bagenholm // J. Cranio-Maxillofac. Surg.– 2008.– V.36, №7.– P. 395-402.
9. Bak M. Contemporary reconstruction of the mandible / M. Bak, A.S. Jacobson, D. Buchbinder et al. // Oral Oncol.– 2010.– V.46, №2.– P. 71-76.
10. Balasundaram I. Recent advances in reconstructive oral and maxillofacial surgery / I. Balasundaram, I. Al-Hadad, S. Parmar // Brit. J. Oral Maxillofac. Surg.– 2012.– V.50, №8.– P. 695-705.
11. Davies S.D. Bone Morphogenetic Proteins in Craniomaxillofacial Surgery / S.D. Davies, M.W. Ochs // Oral Maxillofac. Surg. Clin. Nor. Am.– 2010.– V.22, №1.– P. 17-31.
12. Deep circumflex iliac artery flap combined with a costochondral graft for mandibular reconstruction / Q. Xingzhou, Z. Chenping, Z. Laiping et al. // Brit. J. Oral Maxillofac. Surg.– 2011.– V.49, №8.– P. 597-601.
13. Mandible reconstruction / B.A. Miles, D.P. Goldstein, R.W. Gilbert et al. // Curr. Opin. Otolaryngol. Head Neck Surg.– 2010.– V.18, №4.– P. 317-322.
14. The modular endoprosthesis for mandibular body replacement. Part 1: Mechanical testing of the reconstruction / R.C.W. Wong, H. Tideman, M.A.W. Merkx et al. // J. Cranio-Maxillofac. Surg.– 2012.– V.40, №8.– P. 479-486.
15. The modular endoprosthesis for mandibular body replacement. Part 2: Finite element analysis of endoprosthesis reconstruction of the mandible / R.C.W. Wong, H. Tideman, M.A.W. Merkx et al. // J. Cranio-Maxillofac. Surg.– 2012.– V.40, №8.– P. 487-497.